Людський бета-амілоїдний білок (1-42), також відомий як Aβ 1-42, є ключовим фактором у розкритті таємниць хвороби Альцгеймера.Цей пептид відіграє центральну роль у формуванні амілоїдних бляшок, загадкових кластерів, які пошкоджують мозок пацієнтів з хворобою Альцгеймера.Маючи руйнівну дію, він порушує нейронний зв’язок, викликає запалення та індукує нейротоксичність, що призводить до когнітивних розладів і пошкодження нервової системи.Дослідження механізмів його агрегації та токсичності є не лише життєво важливим;це захоплююча подорож до вирішення головоломки хвороби Альцгеймера та розробки майбутніх методів лікування.



Aβ 1-42 є пептидним фрагментом із 42 амінокислот, який утворюється в результаті розщеплення білка-попередника амілоїду (АРР) β- та γ-секретазами.Aβ 1-42 є одним із основних компонентів амілоїдних бляшок, які накопичуються в мозку пацієнтів із хворобою Альцгеймера, нейродегенеративним розладом, що характеризується когнітивними порушеннями та втратою пам’яті.Було показано, що Aβ 1-42 має різні функції та застосування в біологічних і біомедичних дослідженнях, таких як:
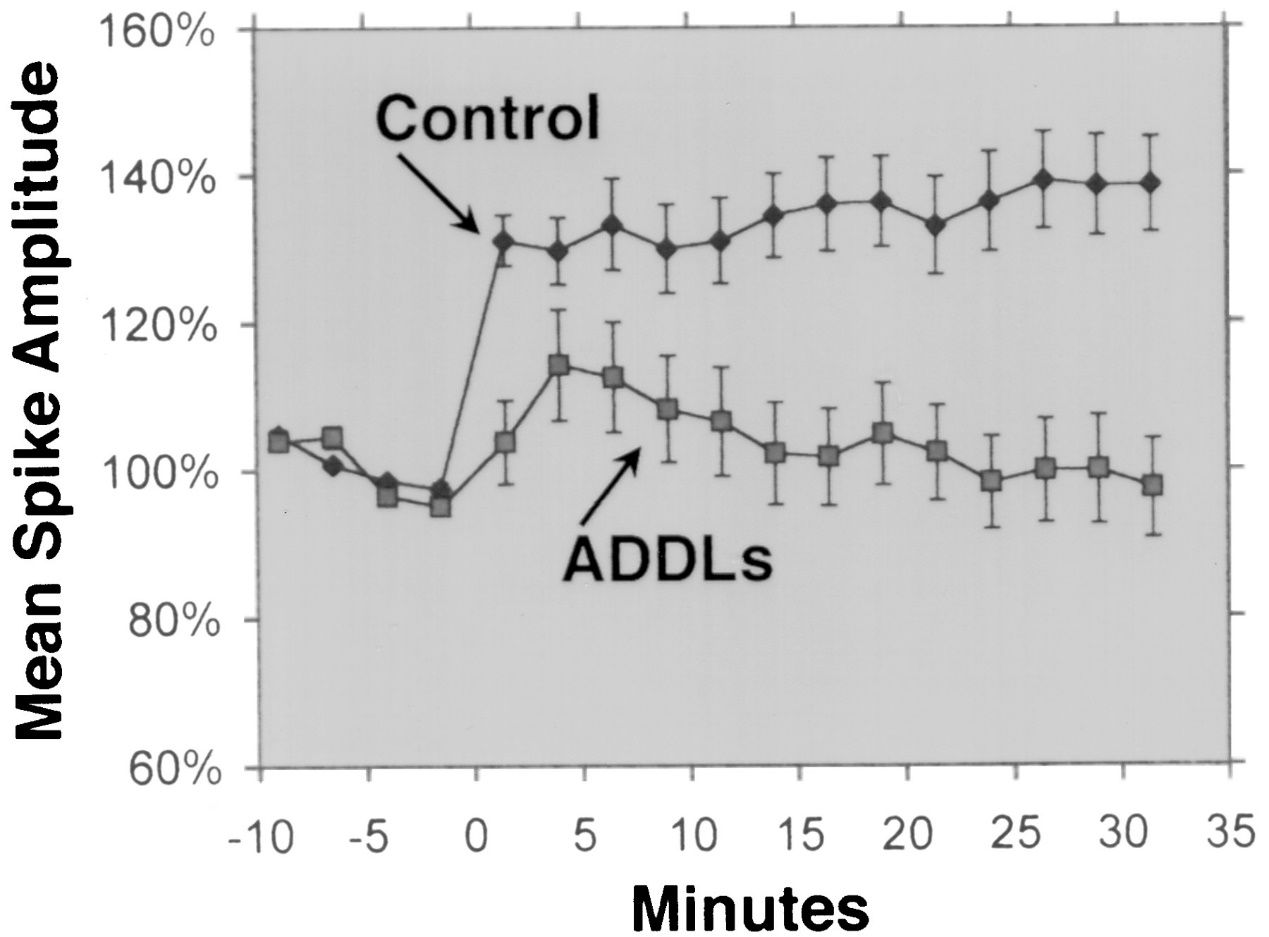
1. Нейротоксичність: Aβ 1-42 може утворювати розчинні олігомери, які здатні зв’язуватися з нейронними мембранами, рецепторами та синапсами та порушувати їх роботу.Ці олігомери також можуть індукувати окислювальний стрес, запалення та апоптоз у нейронах, що призводить до втрати синапсів і смерті нейронів.Олігомери Aβ 1-42 вважаються більш нейротоксичними, ніж інші форми Aβ, такі як Aβ 1-40, який є найпоширенішою формою Aβ у мозку.Також вважається, що олігомери Aβ 1-42 здатні поширюватися від клітини до клітини, подібно до пріонів, і викликати неправильне згортання та агрегацію інших білків, таких як тау, який утворює нейрофібрилярні клубки при хворобі Альцгеймера.
Aβ 1-42 широко вважається ізоформою Aβ з найвищою нейротоксичністю.Кілька експериментальних досліджень продемонстрували нейротоксичність Aβ 1-42 за допомогою різних методів і моделей.Наприклад, Lesné et al.(Brain, 2013) досліджували утворення та токсичність олігомерів Aβ, які є розчинними агрегатами мономерів Aβ, і показали, що олігомери Aβ 1-42 мають сильніший шкідливий вплив на нейрональні синапси, що призводить до зниження когнітивних функцій і втрати нейронів.Ламберт та ін.(Proceedings of the National Academy of Sciences, 1998) підкреслив нейротоксичність олігомерів Aβ 1-42 і виявив, що вони мають сильну токсичну дію на центральну нервову систему, можливо, впливаючи на синапси та нейромедіатори.Walsh та ін.(Nature, 2002) показали інгібуючу дію олігомерів Aβ 1-42 на довгострокове потенціювання гіпокампа (LTP) in vivo, що є клітинним механізмом, що лежить в основі навчання та пам’яті.Це гальмування було пов’язане з порушенням пам’яті та навчання, підкреслюючи вплив олігомерів Aβ 1-42 на синаптичну пластичність.Шанкар та ін.(Nature Medicine, 2008) виділив димери Aβ 1-42 безпосередньо з мозку, що страждає на хворобу Альцгеймера, і продемонстрував їх вплив на синаптичну пластичність і пам’ять, надаючи емпіричні докази нейротоксичності олігомерів Aβ 1-42.
Крім того, Su et al.(Molecular & Cellular Toxicology, 2019) провели аналіз транскриптомії та протеоміки нейротоксичності, індукованої Aβ 1-42, у клітинах нейробластоми SH-SY5Y.Вони ідентифікували декілька генів і білків, на які впливав Aβ 1-42 у шляхах, пов’язаних з процесом апоптозу, трансляцією білка, катаболічним процесом цАМФ і відповіддю на стрес ендоплазматичного ретикулуму.Такеда та ін.(Biological Trace Element Research, 2020) досліджували роль позаклітинного Zn2+ у нейротоксичності, спричиненій Aβ 1-42, при хворобі Альцгеймера.Вони показали, що Aβ 1-42-індукована внутрішньоклітинна токсичність Zn2+ посилюється зі старінням через вікове збільшення позаклітинного Zn2+.Вони припустили, що Aβ 1-42, який безперервно виділяється з терміналів нейронів, викликає вікове зниження когнітивних функцій і нейродегенерацію через внутрішньоклітинну дисрегуляцію Zn2+.Ці дослідження показують, що Aβ 1-42 є ключовим фактором у опосередкуванні нейротоксичності та прогресуванні захворювання при хворобі Альцгеймера шляхом впливу на різні молекулярні та клітинні процеси в мозку.
2. Антимікробна активність: Повідомлялося, що Aβ 1-42 має антимікробну активність проти різних патогенів, таких як бактерії, гриби та віруси.Aβ 1-42 може зв’язуватися з мембранами мікробних клітин і порушувати їх, що призводить до їх лізису та загибелі.Aβ 1-42 також може активувати вроджену імунну систему та рекрутувати запальні клітини до місця інфекції.Деякі дослідження показали, що накопичення β в мозку може бути захисною реакцією на хронічні інфекції або травми.Однак надмірне або нерегульоване виробництво Aβ також може спричинити супутнє пошкодження клітин і тканин господаря.
Повідомлялося, що Aβ 1-42 виявляє антимікробну активність проти ряду патогенів, таких як бактерії, гриби та віруси, такі як Staphylococcus aureus, Escherichia coli, Candida albicans та вірус простого герпесу типу 1, взаємодіючи з їх мембранами та викликаючи їх руйнування та лізис.Кумар та ін.(Journal of Alzheimer's Disease, 2016) продемонстрував цей ефект, показавши, що Aβ 1-42 змінює проникність мембрани та морфологію мікробних клітин, що призводить до їх загибелі.На додаток до своєї прямої антимікробної дії, Aβ 1-42 також може модулювати вроджену імунну відповідь і залучати запальні клітини до місця інфекції.Сосія та ін.(PLoS One, 2010) виявив цю роль, повідомивши, що Aβ 1-42 стимулює вироблення прозапальних цитокінів і хемокінів, таких як інтерлейкін-6 (IL-6), фактор некрозу пухлини альфа (TNF-α), моноцити. хемоаттрактантний білок-1 (MCP-1) і макрофагальний запальний білок-1 альфа (MIP-1α) в мікроглії та астроцитах, основних імунних клітинах мозку.
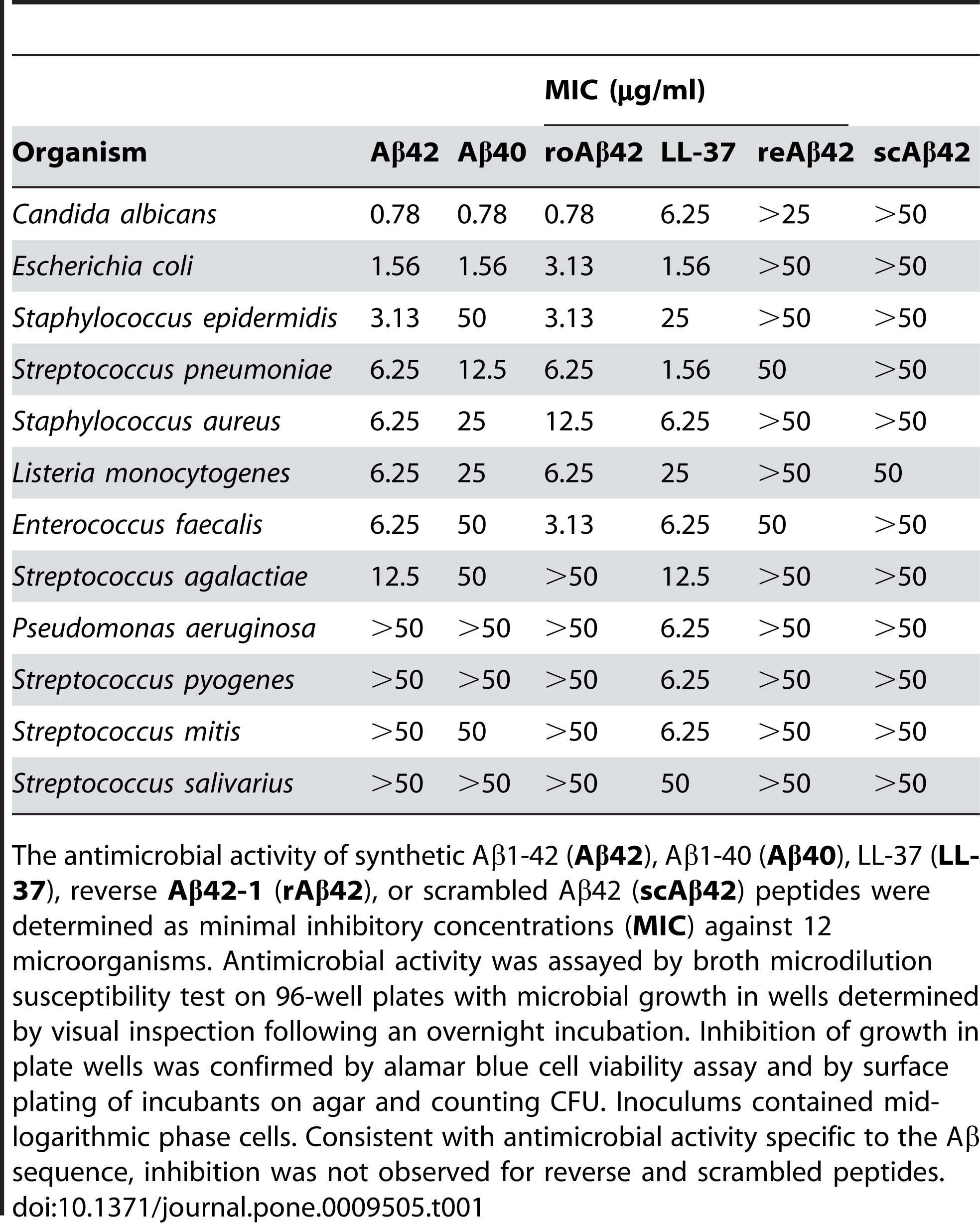
Рисунок 2. Пептиди Aβ мають антимікробну активність.
(Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD. Бета-амілоїдний білок, пов’язаний із хворобою Альцгеймера, є антимікробним пептидом. PLoS One 3 березня 2010 р.;5(3):e9505.)
Хоча деякі дослідження припускають, що накопичення β в мозку може бути захисною реакцією на хронічні інфекції або травми, оскільки β може діяти як антимікробний пептид (AMP) і усувати потенційні патогени, складна взаємодія між β та мікробними елементами залишається тема дослідження.Делікатний баланс підкреслюється дослідженнями Moir et al.(Journal of Alzheimer's Disease, 2018), який передбачає, що незбалансоване або надмірне виробництво Aβ може ненавмисно завдати шкоди клітинам і тканинам хазяїна, що відображає складну подвійну природу ролі Aβ в інфекції та нейродегенерації.Надмірне або нерегульоване виробництво Aβ може призвести до його агрегації та відкладення в мозку, утворюючи токсичні олігомери та фібрили, які порушують функцію нейронів і викликають нейрозапалення.Ці патологічні процеси пов’язані зі зниженням когнітивних функцій і втратою пам’яті при хворобі Альцгеймера, нейродегенеративному розладі, що характеризується прогресуючою деменцією.Таким чином, баланс між корисними та шкідливими ефектами Aβ має вирішальне значення для підтримки здоров’я мозку та запобігання нейродегенерації.
3. Експорт заліза: Показано, що Aβ 1-42 бере участь у регуляції гомеостазу заліза в мозку.Залізо є важливим елементом для багатьох біологічних процесів, але надлишок заліза також може викликати окислювальний стрес і нейродегенерацію.Aβ 1-42 може зв’язуватися із залізом і сприяти його експорту з нейронів через феропортин, трансмембранний транспортер заліза.Це може допомогти запобігти накопиченню заліза та токсичності в мозку, оскільки надлишок заліза може спричинити окислювальний стрес і нейродегенерацію.Дуче та ін.(Cell, 2010) повідомили, що Aβ 1-42 зв’язується з феропортином і збільшує його експресію та активність у нейронах, що призводить до зниження рівня внутрішньоклітинного заліза.Вони також показали, що Aβ 1-42 знижує експресію гепсидину, гормону, який інгібує феропортин, в астроцитах, ще більше посилюючи експорт заліза з нейронів.Однак зв’язаний із залізом Aβ також може стати більш схильним до агрегації та відкладення у позаклітинному просторі, утворюючи амілоїдні бляшки.Ейтон та ін.(Journal of Biological Chemistry, 2015) повідомили, що залізо сприяє утворенню олігомерів і фібрил Aβ in vitro та in vivo.Вони також показали, що хелатування заліза знижує агрегацію та відкладення Aβ у трансгенних мишей.Таким чином, баланс між корисним і шкідливим впливом Aβ 1-42 на гомеостаз заліза є вирішальним для підтримки здоров’я мозку та запобігання нейродегенерації.
Ми є виробником поліпептидів у Китаї та маємо багаторічний досвід виробництва поліпептидів.Hangzhou Taijia Biotech Co., Ltd. є професійним виробником поліпептидної сировини, яка може надати десятки тисяч поліпептидної сировини, а також може бути налаштована відповідно до потреб.Якість поліпептидних продуктів чудова, а чистота може досягати 98%, що було визнано користувачами в усьому світі. Ласкаво просимо до нас.






